《毒理学关注阈值(TTC)方法应用技术指南》
一、概述
毒理学关注阈值(Threshold of Toxicological Concern,TTC)方法是基于化学物质低于一定阈值的暴露剂量对人体产生的危害风险极低的基本假设。关键是确定是否适用于TTC,且不能低估暴露量。
本指南介绍了TTC在化妆品安全评估中的应用,明确了TTC方法的适用范围、术语和释义、物质分类、评估程序以及混合物的使用要求。
二、适用范围
本指南适用于化学结构明确,含量较低且缺乏系统毒理学研究数据的化妆品原料或风险物质。
以下原料或风险物质不适用于本指南,包括:金属或金属化合物、强致癌物(如黄曲霉毒素、亚硝基化合物和联苯胺类等)、蛋白质、类固醇、高分子质量的物质、有很强生物蓄积性物质以及放射性化学物质等;纳米原料、无机物、具有吸入风险的原料在评估其吸入暴露途径的安全风险性时;具有防腐、防晒、着色、染发和祛斑美白功能的原料。
三、术语和释义
(一)毒理学关注阈值(Threshold of Toxicological Concern,TTC)
在该暴露水平下,预计不存在危害人类健康的风险。
(二)全身暴露量(Systemic Exposure Dosage,SED)
通过各种暴露途径进入体循环的待评估物质的预计量,通常以μg/kg bw/day表示。
(三)DNA反应性致突变物/致癌物(DNA-Reactive Mutagens/Carcinogens)
直接作用于DNA,可能导致DNA损伤或复制错误的物质或通过与DNA作用诱导细胞癌变的物质。
(四)Cramer类别(Cramer Class)
在TTC评估中,根据化学物质的分子结构和毒性将化学物质分为三类,分别为Cramer I类、Cramer II类和Cramer III类。
四、物质分类
根据待评估物质是否具有遗传毒性或遗传毒性/DNA反应性警示结构,分为DNA反应性致突变物/致癌物和非DNA反应性致突变物/致癌物。
(一)DNA反应性致突变物/致癌物的TTC阈值
DNA反应性致突变物/致癌物的TTC为0.0025 µg/kg bw/day,基于标准成人体重60 kg。
(二)非DNA反应性致突变物/致癌物的TTC阈值
根据待评估物质化学结构和代谢物安全性相关的问题或应用国际公认的化合物结构评估软件判断Cramer类别,分类流程见附录1。非DNA反应性致突变物/致癌物分为Cramer I类、Cramer II类和Cramer III类物质。
Cramer I类:具有简单化学结构,能被有效代谢的物质,其经口毒性较低。包括:支链无环脂肪烃、普通碳水化合物、普通萜类、不具有特定官能团脂肪族化合物的磺酸盐或氨基磺酸盐等。这类物质的TTC为46 µg/kg bw/day,基于标准成人体重60 kg。
Cramer III类:具有不能初步假定安全性高、甚至可能显示出有明显的毒性或含有反应性官能团化学结构的物质,包括含脂肪族仲胺、氰基、亚硝基、重氮、三氮烯或季铵氮原子的化合物;含除碳、氢、氧、氮或二价硫以外元素且这些元素非以简单阴阳离子形式存在的物质;某些苯衍生物;某些杂环物质;含有三种以上特定官能团且包含游离不饱和杂原子的脂肪族物质等。这类物质的TTC为2.3 µg/kg bw/day,基于标准成人体重60 kg。
Cramer II类:具有比Cramer I类物质毒性强、但不像Cramer III类物质具有明显毒性结构特征的物质。包括除醇、醛、侧链酮、酸、酯之外没有其他官能团的物质;含简单取代基的单碳环且无环缩醛或缩酮的化合物,单环烷酮或带有或不带有环酮的双环物质等。这类物质的TTC为2.3 µg/kg bw/day,基于标准成人体重60 kg。
五、评估程序
依次按以下步骤开展评估,评估程序流程图见附录2。
(一)判断待评估物质是否符合TTC的适用范围
判断待评估物质是否符合TTC方法的适用范围。如果符合,可采用TTC方法对该物质开展评估。如果不符合,需要按照《化妆品安全评估技术导则(2021年版)》(以下简称《导则》)要求进行安全评估。
(二)计算全身暴露量(SED)
按照《导则》中4.3规定的方法计算待评估物质的SED。
(三)待评估物质是否为DNA反应性致突变物/致癌物
若待评估化学物质无遗传毒性试验数据,可采用(定量)构效关系预测方法学进行预测或开展遗传毒性/DNA反应性终点的试验(细菌回复突变试验或其它与DNA反应性相关的基因突变试验)。
采用(定量)构效关系预测方法进行预测时,应至少采用两种互补的国际公认的预测方法,一种方法应基于专家知识规则,另一种方法应基于统计学。若经两种互补的方法(专家知识规则和统计学)预测均没有警示结构,则判定该化学物质为非DNA反应性致突变物/致癌物。若任意一种预测方法警示待评估化学物质可能具有遗传毒性/DNA反应性,则需开展遗传毒性/DNA反应性终点试验,根据证据权重原则判定是否为DNA反应性致突变物/致癌物。
(四)待评估物质是DNA反应性致突变物/致癌物
如SED > 0.0025 µg/kg bw/day,该物质引起癌症的风险性较高。
如SED ≤ 0.0025 µg/kg bw/day,则待评估物质在当前使用条件下的风险在可接受范围之内。
(五)待评估物质是非DNA反应性致突变物/致癌物
判断Cramer类别,并与相应的阈值进行比较。
如待评估物质属于Cramer I类物质,SED > 46 µg/kg bw/day,该物质需要按照《导则》进一步开展安全评估;SED ≤ 46 µg/kg bw/day,则待评估物质在当前使用条件下的风险在可接受范围之内。
如待评估物质属于Cramer II或Cramer III类物质,SED > 2.3 μg/kg bw/day,该物质需要按照《导则》进一步开展安全评估;SED ≤ 2.3 μg/kg bw/day,则待评估物质在当前使用条件下的风险在可接受范围之内。
六、混合物
对于混合物如植物提取物,需确定待评估物质是否为DNA反应性致突变物/致癌物,尽可能多的识别出单一或大类成分,除生产过程中添加的必要溶剂或稳定剂、防腐剂、抗氧化剂等外,需确定成分含量不低于50 %。对于已知成分,分别采用适宜的评估方法进行安全评估,以确保使用安全,若含有结构类似的成分,应进行剂量叠加评估。对于属于非DNA反应性致突变物/致癌物的未知成分,若无法确定Cramer类别,其整体的Cramer类别按Cramer III类进行评估。对不能排除DNA反应性致突变物/致癌物的未知成分,采用DNA反应性致突变物/致癌物的TTC阈值进行评估。
附录1
非DNA反应性致突变物/致癌物Cramer类别分类流程
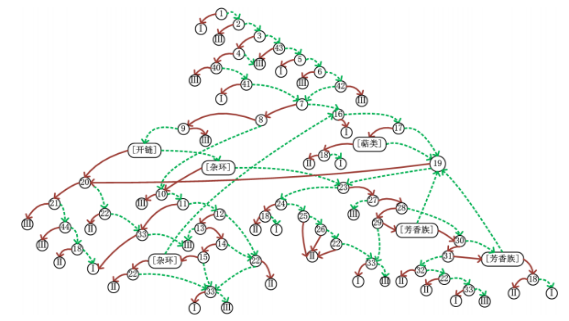
图1 非DNA反应性致突变物/致癌物Cramer类别分类流程图
图1中,1-33、40-44代表附-表1中相应“问题编号”的“关于目标物化学结构和(或)代谢物安全性相关的问题”,I、II、III分别代表Cramer I类、Cramer II类、Cramer III类。当每个问题判断结果为“是”时,通过实线箭头指向下一个问题编号或者Cramer类别。当每个问题判断结果为“否”时,通过虚线箭头指向下一个问题编号或者Cramer类别。
表1展示了Cramer决策树的问题流程,包括初始问题(Q 1-33)和扩展问题(Q 40-44)。
表1 非DNA反应性致突变物/致癌物Cramer类别分类流程表
问题编号 | 关于目标物化学结构和(或)代谢物安全性相关的问题 | 如果是,确定Cramer类别 | 如果是,转到问题编号 | 如果否,确定Cramer类别 | 如果否,转到问题编号 |
1 | 属于机体的正常组分或其旋光异构体(激素、环境和食物污染物的代谢产物、疾病状态下的代谢产物除外) | I 类 | 2 | ||
2 | 包含增强毒性的官能团[脂肪族仲胺或其盐、氰基、N-亚硝基、重氮(例如CH2N2)、三氮烯(RN=NNH2)或季氮,同时以下形式除外:>C=N+R2、>C=N+H2、伯胺或叔胺的盐酸盐或硫酸盐] | III 类 | 3 | ||
3 | 包含除碳、氢、氧、氮、二价硫以外的其他元素 | 4 | 43 | ||
4 | 包含问题3中未列出的元素,且仅以(1)羧酸的钠、钾、钙、镁、铵盐形式,或(2)胺的硫酸盐、盐酸盐形式,或(3)钠、钾、钙的磺酸盐、氨基磺酸盐、硫酸盐形式出现 | 40 | III 类 | ||
40 | 属于可能有害的有机磷酸酯类或有机硫代磷酸酯类 | III 类 | 41 | ||
41 | 排除磷酸酯(盐)类 | I 类 | 7 | ||
7 | 杂环 | 8 | 16 | ||
8 | 内酯或环状二酯 | 9 | 10 | ||
9 | 结合到另一个环上的内酯,或五元或六元的α,β-不饱和内酯 | III 类 | [开链] | ||
[开链] | 开链 | 20 | [杂环] | ||
20 | 线性或支链脂肪族化合物,且仅含以下官能团中的任何一种或组合:(1)羟基、醛基、羧酸或酯基各一个,少于或等于四种,和/或(2)含有一种或多种官能团,每种一个:乙缩醛、酮或缩酮(但不能兼有)、硫醇、硫化物(单硫化物或多硫化物)、硫酯、聚氧乙烯基[(-OCH2CH2-)x,x ≤4]、伯胺或叔胺 | 21 | 22 | ||
21 | 包含3种及以上不同类型的官能团(不包括甲氧基,且将酸和酯视为同一种官能团) | III 类 | 44 | ||
44 | 包含游离的α,β-不饱和官能团 | III 类 | 18 | ||
18 | 属于下列物质之一:(1)邻二酮,或是与乙烯基末端相连的酮或酮的缩酮;(2)与末端乙烯基相连的仲醇或仲醇的酯;(3)烯丙醇或其缩醛、缩酮或酯衍生物;(4)烯丙基硫醇、烯丙基硫化物、烯丙基硫酯或烯丙基胺;(5)丙烯醛,甲基丙烯醛或其缩醛;(6)丙烯酸或甲基丙烯酸;(7)乙炔化合物;(8)不含其它官能团的非环状脂肪族酮、缩酮或酮醇,且酮基两侧具有四个或更多碳原子;(9)官能团均受到空间位阻的物质 | II 类 | I 类 | ||
22 | 食物中的常见成分或与其结构类似 | II 类 | 33 | ||
33 | 有足够数量的磺酸基或磺胺基 | I 类 | III 类 | ||
[杂环] | 杂环 | 10 | 23 | ||
10 | 三元杂环(例如环氧化合物、乙撑亚胺(ethylenimine)等) | III 类 | 11 | ||
11 | 含有复杂取代基的杂环,而不仅是:简单的支链烃(包括桥链和单环芳基或烷基结构)、烷基醇、醛、缩醛、酮、缩酮、酸、酯(包括内酯以外的环酯)、硫醇、硫化物、甲基醚、羟基或单环(杂基或芳基) | 33 | 12 | ||
12 | 芳杂环 | 13 | 22 | ||
13 | 环上有取代基 | 14 | III 类 | ||
14 | 含有不止一个芳环 | 15 | 22 | ||
15 | 易水解为单核残留物 | [杂环] | 33 | ||
[杂环] | 杂环 | 22 | 16 | ||
16 | 常见的萜类化合物(如萜烃、萜醇、萜醛或萜酸,但不是酮) | I 类 | 17 | ||
17 | 易水解为常见萜类化合物(如萜烃、萜醇、萜醛或萜酸) | [萜类] | 19 | ||
[萜类] | 常见萜类 | 18 | 19 | ||
19 | 开链化合物 | 20 | 23 | ||
23 | 芳香族化合物 | 27 | 24 | ||
27 | 环上有取代基 | 28 | III 类 | ||
28 | 含有一个以上的芳香环 | 29 | 30 | ||
29 | 易水解为单核残留物 | [芳香族] | 33 | ||
[芳香族] | 芳香族 | 30 | 19 | ||
30 | 含有复杂取代基的芳香环(不考虑环上的羟基或甲氧基,环上含有1-5个碳的脂族族基团以外的取代基:,烃或醇、酮、醛、羧基或者可以水解为含有5个或更少碳的环取代基的简单酯) | 31 | [芳香族] | ||
31 | 符合问题30定义的非环状缩醛或酯类衍生物 | [芳香族] | 32 | ||
[芳香族] | 芳香族 | 18 | 19 | ||
32 | 仅含有问题30中列出的官能团,或是问题31列出的衍生物,但具有以下任何一种或全部情况:(1)单一结合的非芳香族碳环;(2)长于五个碳原子的脂肪族取代碳链;(3)在芳香环或脂肪侧链上有聚氧乙烯短链[(-OCH2CH2-)x,x≤4]。 | II 类 | 22 | ||
24 | 单环碳环(不包括环丙烷或环丁烷及其衍生物),具有环或脂肪族侧链,无取代基或仅含醇、醛、侧链酮、酸、酯、磺酸的钠/钾/钙盐或氨基磺酸的钠/钾/钙盐、无环缩醛或缩酮取代基 | 18 | 25 | ||
25 | 化合物是(1)仅含有问题24中提到的取代基的环丙烷、环丁烷,或(2)单环或双环硫化物或硫醇 | II 类 | 26 | ||
26 | 不含问题24中提到的以外的取代基,且是单环烷酮或双环化合物(含或不含环酮) | II 类 | 22 | ||
43 | 含有非天然的二价硫(未被问题3识别到) | III 类 | 5 | ||
5 | 简单支链的无环脂肪族烃或者常见的碳水化合物 | I 类 | 6 | ||
6 | 仅含以下取代基的苯衍生物:(1)烃链或l'-羟基或羟基酯取代的烃链,(2)一个或多个烷氧基,其中一个必须与(1)的烃链处于对位 | III 类 | 42 | ||
42 | 可能是有害的苯类似物(如具有0到6个单原子取代基的单芳香环化合物) | III 类 | 7 |
附录2
TTC法评估程序流程图
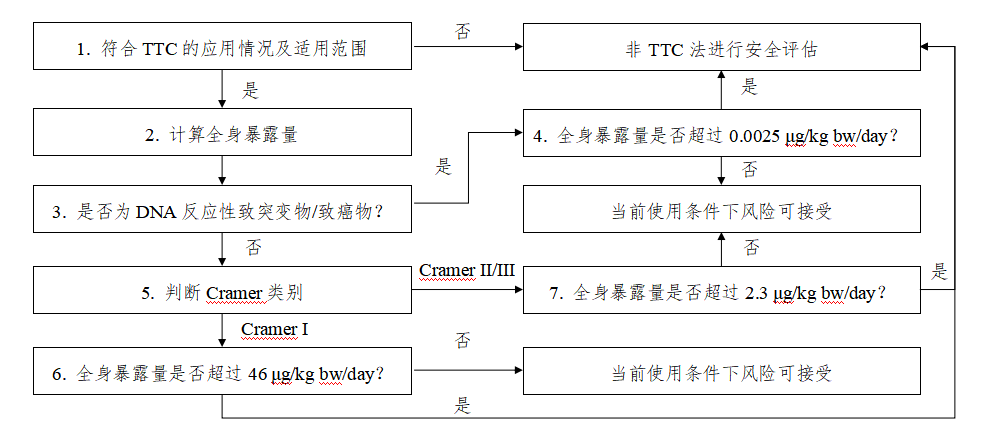
图2 TTC应用于化妆品安全评估的评估程序流程图
附录3
TTC法在化妆品原料安全评估中应用示例
(化学物质)
注:实例所用数据非真实数据,仅供方法参考。
一、待评估物质信息
中文名称:己基癸醇,《已使用化妆品原料目录(2021年版)》中03202号
INCI名称/英文名称:HEXYLDECANOL
CAS号:2425-77-6
化妆品中浓度及使用产品类别:0.0001 %,身体乳
分子式:C16H34O
结构式:
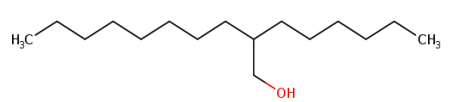
二、待评估物质基本理化特性
物理状态: 无色液体
熔点/凝固点: -69 ℃
相对密度: 0.8369,20 ℃
沸点: 300 ℃
蒸汽压: 0.004 mbar,38 ℃
溶解度: <1 mg/L
脂水分配系数: 6.66
闪点: 159 ℃
燃点: 238 ℃
粘度: 41.1 mPa s,20 ℃
三、待评估物质毒理学信息
急性毒性:根据供应商测试,该原料在大鼠急性经口毒性试验中,LD50 >5000 mg/kg且无动物死亡,表明该原料急性经口毒性为实际无毒级;
皮肤刺激性:在家兔多次皮肤刺激试验中,采用0.1 %的该原料进行试验,显示该成分为无刺激性;
皮肤光毒性和光变态反应:经毒理学测试或分析判断,该原料无光毒性和光变态反应性;
皮肤致敏性:根据供应商测试,局部封闭涂皮(Buehler Test, BT)试验中,采用0.1 %的该原料进行测试,未见皮肤变态反应;
遗传毒性/DNA反应性终点:经细菌回复突变试验测试或软件(QSAR Toolbox和VEGA)预测并经分析判断,该原料遗传毒性/DNA反应性终点为阴性;
其他:未收集到该成分其他毒理学信息。
四、评估步骤
(一)判断待评估物质是否符合TTC使用范围
已知待评估物质的化学结构,在产品中的含量较低,主要暴露途径为经皮,暴露量可计算,缺乏系统毒理学数据,且不属于需排除的情形,故可用TTC法进行评估。
(二)计算全身暴露量
全身暴露量(SED):SED =日均使用量×驻留因子×成分在配方中百分比×经皮吸收率÷体重
其中:日均使用量为7.82 g/day,参考《THE SCCS NOTES OF GUIDANCE FOR THE TESTING OF COSMETIC INGREDIENTS AND THEIR SAFETY EVALUATION(12TH REVISION)》;
驻留因子:1.00;
体重一般为默认的成人体重:60 kg;
经皮吸收率以100 %计。
SED=7.82×106×1.00×0.0001%×100%÷60 = 0.13 µg/kg bw/day。
(三)待评估物质是否为DNA反应性致突变物/致癌物
该物质为非DNA反应性致突变物/致癌物。
(四)结论
根据物质分类原则或使用分类软件(Toxtree或QSAR Toolbox等)并经确认,己基癸醇属于Cramer I类物质。身体乳中浓度为0.0001 %的己基癸醇的全身暴露量为0.13 µg/kg bw/day,小于Cramer I类物质的毒理学关注阈值46 µg/kg bw/day。
综上所述,对己基癸醇的毒理学信息和TTC评价结果等进行综合评价,认为身体乳中使用浓度为0.0001 %的己基癸醇时,在正常、合理的及可预见的使用条件下,不会对人体健康产生危害。
五、参考文献
略。
附录4
TTC法在化妆品原料安全评估中应用示例
(植物提取物)
注:实例所用数据非真实数据,仅供方法参考。
一、待评估物质信息
中文名称:某植物提取物,《已使用化妆品原料目录(2021年版)》中※号
IINCI名称/英文名称:※ EXTRACT
化妆品中的浓度及使用产品类别:0.1 %,面霜
二、待评估物质基本理化特性
略。
三、待评估物质成分分析
该物质为植物提取物,通过文献检索或成分分析,未知成分总量为8.16 %,具体见表1。
表1 该植物提取物成分及含量表
成分 | 含量(%) |
纤维素 | 25.45 |
蔗糖 | 10.5 |
…… | …… |
积雪草酸 | 7.05 |
矿物质 | 6.67 |
水 | 5 |
植物甾醇类 | 4.95 |
…… | …… |
未知成分 | 8.16 |
四、待评估物质毒理学信息
急性毒性:根据供应商测试,含2.0 %该植物提取物的原料在大鼠急性经口毒性试验中,LD50 > 5000 mg/kg 且无动物死亡,表明该原料急性经口毒性为实际无毒级;
皮肤刺激性:根据供应商测试,在家兔多次皮肤刺激试验中,采用含2.0 %该植物提取物的原料进行试验,显示该成分为无刺激性;
皮肤光毒性和光变态反应:根据供应商测试,采用含2.0 %该植物提取物的原料进行试验,未见皮肤光毒性和光变态反应;
皮肤致敏性:供应商数据显示,局部封闭涂皮(Buehler Test, BT)试验中,采用含2.0 %该植物提取物的原料进行测试,未见皮肤变态反应;
遗传毒性/DNA反应性终点:进行细菌回复突变试验,含2.0 %该植物提取物的原料结果为阴性;
其他:未收集到该成分其它毒理学信息。
五、评估步骤
(一)判断待评估物质是否符合TTC使用范围
待评估物质的暴露量可计算,缺乏系统毒理学数据,且不属于需排除的情形,故可用TTC法进行评估。
(二)待评估物质是否为DNA反应性致突变物/致癌物
该植物提取物为非DNA反应性致突变物/致癌物。
(三)识别出成分是否符合方法应用要求
该植物提取物识别出成分含量超过50%,未知成分含量为8.16 %,符合混合物的TTC使用技术要求。
(四)已知成分的风险评估
1. 纤维素
纤维素,INCI名称CELLULOSE,属于一般认为安全物质(GRAS)。CIR评估结果显示,使用浓度为0.002 % ~ 99 %时,纤维素在驻留类化妆品中的实际使用都是安全的。该植物提取物中含有25.45 %的纤维素,产品中含量为0.025 %。纤维素在本产品中的应用风险在可接受范围之内。
2. 其他成分
分别采用适宜的评估方法进行了安全评估,若含有结构类似的成分,进行剂量叠加评估。
具体各成分评估内容略。
(五)未知成分的风险评估
该植物提取物遗传毒性/DNA反应性终点为阴性,未知成分的含量为8.16 %,将未知成分当作整体计算全身暴露量,与TTC最低的Cramer III类别对比。未知成分在产品中的暴露量为:
SED = 1.54×106×1.00×0.1%×8.16%×100%÷60=2.09 µg/kg bw/day,低于2.3 µg/kg bw/day,在当前使用条件下,未知成分在本产品中的应用风险在可接受范围之内。
六、综合评价
基于权重证据,包括该植物提取物已知成分的毒理学结果、CIR评估报告、食用历史等,证明了在当前使用条件下,已知成分的风险在可接受范围之内;未知成分的全身暴露量SED低于Cramer III类别的阈值2.3 µg/kg bw/day,说明在当前使用条件下,未知成分的风险在可接受范围之内。
综上所述,经对该植物提取物的已知成分和未知成分的评估结果进行综合评价,认为该植物提取物在面霜中使用浓度为0.1 %时,在正常、合理的及可预见的使用条件下,不会对人体健康产生危害。
七、参考文献
略。
- 中国《化妆品新原料备案目录》2021-2023年最新清单
- 中国已使用化妆品原料目录2021版
- 化妆品执行标准大全
- 化妆品违禁词审核系统
- 《化妆品安全技术规范》(2015年版)
- 化妆品法律法规汇编2024版
- 2023《国产普通化妆品备案问题解答500例》全文
- 中国《化妆品禁用原料目录》2021版
- 化妆品安全评估工具_化妆品配方成分审核工具_李锦聪
- 中国《化妆品准用防腐剂(表4)》2015版


